Resultados finales del ensayo fase III PROpel
MSD y AstraZeneca han presentado los resultados finales del criterio de valoración secundario clave de supervivencia global del ensayo fase III PROpel
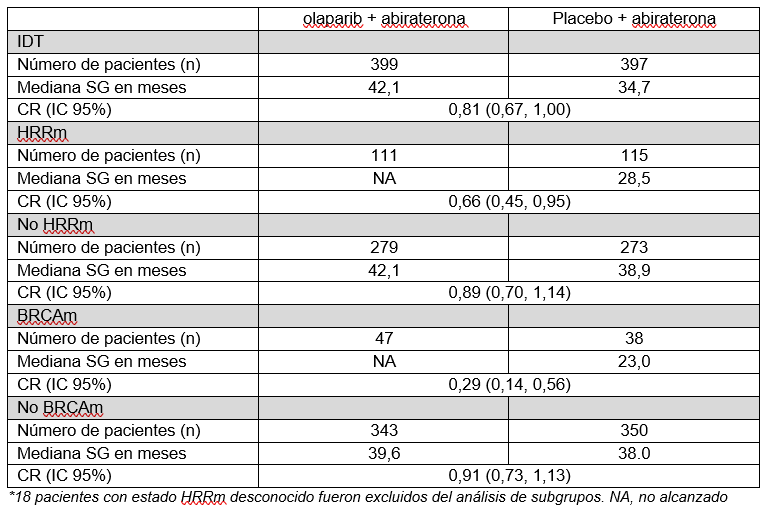
Los resultados del análisis final de supervivencia global (SG) preespecificado del ensayo fase III PROpel en cáncer de próstata metastásico resistente a la castración (CPRCm) mostraron que Lynparza (olaparib) de MSD y AstraZeneca en combinación con abiraterona y prednisona o prednisolona dieron como resultado una mediana de supervivencia global de 42,1 meses frente a 34,7 meses para abiraterona más placebo. Este resultado representó una diferencia absoluta de 7,4 meses en la mediana de la SG frente a un tratamiento de referencia (47,9 % de madurez, Hazard ratio [HR] de 0,81, intervalo de confianza [IC] del 95 % 0,67-1,00; p=0,0544).
Si bien este aumento numérico en la mediana de la SG no fue estadísticamente significativo, esta actividad clínica se sumó a la supervivencia lograda para los pacientes en este contexto tratados con abiraterona sola, tratamiento de referencia actual. Estos resultados se anunciaron en una presentación oral en el Simposio sobre cánceres genitourinarios (GU) de la Sociedad Americana de Oncología Clínica (ASCO) de 2023 (#LBA16).
En el análisis principal presentado en ASCO GU 2022, y publicado en The New England Journal of Medicine Evidence, PROpel cumplió su criterio de valoración principal de supervivencia libre de progresión radiográfica (SLPr), demostrando que la combinación redujo el riesgo de progresión de la enfermedad o muerte en un 34% frente a abiraterona sola (CR 0,66; IC del 95% 0,54-0,81; p<0,0001).
Noel Clarke, urólogo y catedrático de oncología urológica en los Hospitales Christie/Salford Royal de Manchester y la Universidad de Manchester, e investigador principal en el ensayo PROpel, señaló: “Desde el análisis de supervivencia libre de progresión radiológica, criterio de valoración principal presentado en ASCO GU el año pasado, hasta los datos actualizados de supervivencia global presentados en esta edición, los datos refuerzan el potencial terapéutico de olaparib más abiraterona y prednisona para pacientes con cáncer de próstata metastásico resistente a la castración en la población general del ensayo y en todos los subgrupos. Los resultados de PROpel son importantes tanto para los pacientes como para la comunidad oncológica, ya que respaldaron esta combinación como una nueva opción de tratamiento potencial, especialmente necesaria en el cáncer de próstata metastásico resistente a la castración”.
El Dr. Eliav Barr, director de Desarrollo Clínico Global y director médico de MSD Research Laboratories, indicó que: “El cáncer de próstata es el segundo cáncer más frecuentemente diagnosticado en pacientes con asignación de sexo masculino al nacer, y se estima que la mortalidad casi se duplicará en los próximos 20 años. Con opciones de tratamiento limitadas para estos pacientes, reconocemos la necesidad crítica de terapias que puedan retrasar la progresión de la enfermedad. Estamos orgullosos de nuestra colaboración con AstraZeneca mientras trabajamos juntos para avanzar en las revisiones regulatorias pendientes y ofrecemos una nueva opción de tratamiento a la comunidad del cáncer de próstata”.
La vicepresidenta ejecutiva de I+D en oncología de AstraZeneca Susan Galbraith, señaló que: “Tanto PARP, como el receptor de andrógenos son importantes en el proceso de reparación del ADN en el cáncer de próstata. Los resultados en la población general del ensayo PROpel ilustraron cómo la combinación puede aprovechar la dependencia del receptor de andrógenos en la reparación del ADN por parte de PARP, para proporcionar una mayor actividad anticancerosa que la abiraterona sola. Basándose en la totalidad de los datos, hay que destacar que esta combinación brindó un beneficio en una amplia población de pacientes en este contexto, lo que se ve respaldado aún más por la reciente indicación aprobada en la UE”.
Resumen de los resultados del criterio de valoración secundario de SG entre subgrupos
La seguridad y tolerabilidad de la combinación se mantuvo según lo observado en ensayos clínicos anteriores y los perfiles conocidos de los medicamentos individualmente. En el momento de este análisis actualizado, no se identificaron nuevos problemas de seguridad a largo plazo.
Los acontecimientos adversos (AA) más frecuentes en el grupo de la combinación de fármacos (mayor o igual al 20% de los pacientes), fueron anemia (49,7%), cansancio (38,7%), náuseas (30,7%), lumbalgia (21,6%) y diarrea (20,6%). Aproximadamente el 83% de los pacientes tratados experimentaron algún AA seguían en tratamiento en el momento del corte de los datos.
Esta combinación con abiraterona y prednisona o prednisolona, fue aprobada por la Comisión Europea en Diciembre de 2022 para el tratamiento de pacientes adultos con CPRCm, en los que la quimioterapia no está indicada a juicio del clínico y actualmente se encuentra en revisión regulatoria en otros países.